La ricerca, condotta dall’Istituto Europeo di Oncologia, sostenuta da Fondazione AIRC e da Worldwide Cancer Research, è pubblicata sulla rivista Hepatology
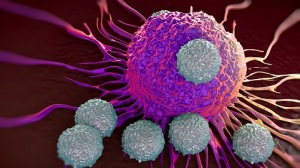
Milano 3 febbraio 2020 – Un gruppo di ricercatori dell’Istituto Europeo di Oncologia, diretti da Bruno Amati e Arianna Sabò, ha scoperto una “firma molecolare”, ovvero un insieme di geni concatenati fra loro, che caratterizza un sottogruppo aggressivo di carcinomi epatocellulari. La scoperta apre la strada allo sviluppo di nuove opzioni terapeutiche per questo tumore, per cui le possibilità di cura sono attualmente limitate. I risultati dello studio, sostenuto da Fondazione AIRC e da Worldwide Cancer Research, sono pubblicati sulla rivista scientifica Hepatology.
“I tumori del fegato, di cui il carcinoma epatocellulare è la forma più diffusa, sono la quarta causa di morte per tumore nel mondo – dichiara Bruno Amati, Direttore di Unità presso il Dipartimento di Oncologia Sperimentale IEO – Nonostante diverse alterazioni genomiche alla loro origine siano note da tempo, i meccanismi molecolari alla base dello sviluppo di questo tumore sono stati solo parzialmente compresi, limitando la possibilità di identificare farmaci biologici mirati ed efficaci. Per questo, aver identificato la firma molecolare, formata dai geni Myc, b-Catenina, Yap e Taz, è una tappa di importanza scientifica e clinica fondamentale, perché questi oncogeni possono essere i bersagli da colpire per fermare la malattia”.
“Sapevamo che in una frazione di carcinomi epatocellulari c’è la concomitante alterazione di Myc e b-catenina, ma non sapevamo quale fosse il meccanismo alla base della loro cooperazione nel promuovere l’insorgenza dei tumori epatici – spiega Andrea Bisso, primo autore dello studio – In un animale di laboratorio abbiamo dunque riprodotto una configurazione genica nella quale, a seguito dell’attivazione di Myc e b-catenina, si sviluppano dei tumori simili a quelli osservati nei pazienti”.
“Il loro studio ci ha permesso di identificare la firma molecolare, che abbiamo ribattezzato “firma Myc/b-catenina”, che caratterizza questi tumori – prosegue Bisso – L’analisi di questa firma ha rivelato che essa è dipendente da altri due oncogeni ‘gemelli’, Yap e Taz, la cui rilevanza nel contesto tumorale sta emergendo prepotentemente negli ultimi anni. In sintesi ciò che sembra avvenire nello sviluppo del tumore epatocellulare è che quando Myc e b-catenina si attivano, mandano un segnale d’azione a Yap e Taz, i quali a loro volta sostengono la proliferazione illimitata e la trasformazione maligna delle cellule epatiche”.
“Dunque abbiamo capito che la coattivazione di Myc e b-catenina è funzionale allo sviluppo del tumore e che la loro connessione è orchestrata da Yap e Taz – continua Arianna Sabò, coordinatrice dello studio – Questo meccanismo ha importanti implicazioni prognostiche: abbiamo infatti dimostrato che lo stesso avviene anche nei pazienti affetti da carcinoma epatocellulare, in cui l’alta espressione della firma Myc/b-catenina funziona come indice di forte aggressività del tumore ed è correlata a una prognosi peggiore”.
“La sfida che si pone ora è dunque bloccare questa triade oncogenica tra Myc, b-catenina e Yap e Taz – conclude Amati – Abbiamo già dimostrato che se eliminiamo geneticamente Yap e Taz, Myc e b-catenina perdono la capacità di coordinarsi e di far proliferare le cellule malate. Yap e Taz rappresentano quindi un bersaglio terapeutico strategico: l’identificazione di molecole o approcci terapeutici in grado di inibirli rappresenta il prossimo passo, che potrebbe fornire nuove possibilità di cura per questo sottogruppo particolarmente aggressivo di tumori epatici”.

 Salva come PDF
Salva come PDF