Grazie alla collaborazione con Intellia Therapeutics, il primo trial clinico dell’innovativa terapia cellulare sviluppata nei laboratori del San Raffaele ha ottenuto il via libera degli enti regolatori in Stati Uniti e Regno Unito e ha iniziato l’arruolamento di pazienti con leucemia mieloide acuta resistente alle attuali terapie

Milano, 10 febbraio 2022 – Un nuovo tipo di linfociti ingegnerizzati, capaci di riconoscere in modo altamente specifico le cellule della leucemia mieloide acuta e di restare in circolo più a lungo, pronti a riattivarsi in caso di recidiva: è questa l’innovativa terapia – che utilizza recettori TCR in grado di riconoscere la proteina tumorale WT1 – messa a punto nei laboratori dell’IRCCS Ospedale San Raffaele di Milano, sotto la guida di Chiara Bonini, vice direttrice della Divisione di Ricerca in Immunologia Trapianti e Malattie Infettive e professore ordinario di Ematologia presso Università Vita-Salute San Raffaele.
La ricerca è frutto della collaborazione con la company statunitense Intellia Therapeutics, leader nel campo della tecnologia di editing con CRISPR/Cas9, con cui Ospedale San Raffaele ha stretto una partnership strategica per accelerare l’ingresso della terapia in clinica. Sulla base dei risultati di sicurezza ed efficacia ottenuti in laboratorio – pubblicati oggi sulla prestigiosa Science Translational Medicine e ampliati dalla company partner – Intellia ha già ottenuto il via libera dagli enti regolatori americani e inglesi per iniziare la prima sperimentazione clinica in pazienti con leucemia mieloide acuta.
Una nuova tecnologia per potenziare il sistema immunitario: quali novità rispetto ai CAR-T
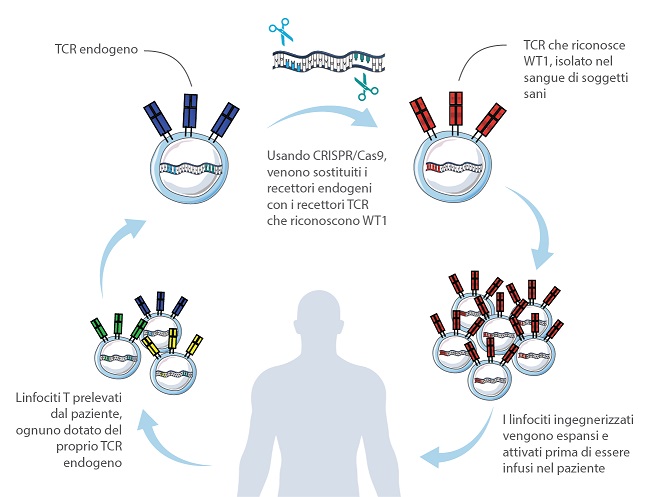
La tecnologia utilizzata dai ricercatori del San Raffaele e di Intellia per potenziare i linfociti consiste nel sostituire, tramite le forbici molecolari CRISPR/Cas9, i recettori naturalmente presenti sulla loro superficie – chiamati TCR, acronimo di “Recettori delle Cellule T” – con altri recettori. I recettori sostitutivi sono anch’essi TCR, precedentemente isolati dal sangue di soggetti sani proprio per la loro capacità di riconoscere una specifica proteina tumorale, in questo caso WT1. Il risultato è la generazione di un’armata di linfociti T altamente specifici per il tumore.
“I recettori TCR sono strumenti molto potenti e versatili. Con questi recettori, infatti, i linfociti ingegnerizzati sono in grado di identificare una cellula tumorale non solo in base alle proteine di superficie che possiede (come nel caso delle terapie CAR-T), ma anche per le proteine o per altri tipi di molecole che sono presenti al suo interno,” spiega Eliana Ruggiero, ricercatrice presso il laboratorio di Chiara Bonini e prima autrice dello studio.
“Questo ha moltissimi vantaggi. Innanzitutto amplia il numero di neoplasie che possiamo trattare, perché amplia il numero di molecole e proteine tumorali che possiamo colpire – prosegue Ruggiero – È inoltre più facile trovare molecole interne indispensabili alla sopravvivenza del tumore, ovvero molecole che il tumore non può sostituire o eliminare per sfuggire alla terapia. È così che abbiamo scelto il nostro target, WT1, una proteina fondamentale per le cellule della leucemia mieloide acuta, tanto da essere utilizzato già oggi in clinica come indicatore di gravità della malattia e per valutare il rischio di recidiva”.
In aggiunta a tutto questo, i recettori TCR, essendo quelli presenti fisiologicamente sui linfociti, sono anche in grado di attivare i meccanismi di memoria immunitaria: quando si attivano promuovono la sopravvivenza della cellula T, che resta pronta nel caso la minaccia si ripresentasse, come avviene durante una recidiva, evento frequente nella leucemia mieloide acuta.
Il team del San Raffaele aveva messo a punto diversi anni fa, per la prima volta, un protocollo per la sostituzione del TCR nei linfociti T. Oggi, grazie all’uso delle CRISPR/Cas9, e al prezioso contributo di Intellia Therapeutics, il protocollo è più semplice ed efficiente, caratteristiche fondamentali per la sperimentazione clinica.
Come risolvere il problema della compatibilità: la costruzione di una libreria di recettori
Rispetto all’approccio CAR-T, i linfociti ingegnerizzati con TCR hanno caratteristiche peculiari e prima di costituire una risposta terapeutica accessibile a tutti potrebbero richiedere tempi più lunghi. “Le sfide da superare per lo sviluppo delle terapie cellulari con linfociti T ingegnerizzati (con CAR o TCR) sono molte. Innanzitutto bisogna identificare la proteina che vogliamo usare come target, nel nostro caso WT1, poi occorre trovare i recettori in grado di riconoscerla. A tal fine, bisogna letteralmente andare a caccia di linfociti che li possiedono in campioni di sangue donati da soggetti sani,” spiega la prof.ssa Chiara Bonini.
“Nel caso dell’approccio TCR, inoltre, ogni terapia cellulare – ovvero ogni specifico recettore TCR – funziona soltanto in uno specifico gruppo di pazienti, quelli che hanno la stessa istocompatibilità della persona sana da cui è stato isolato il recettore. Si tratta di una situazione simile a quella del trapianto di midollo, in cui donatore e ricevente devono essere compatibili. A differenza del trapianto però, in questo caso è sufficiente la compatibilità su un’unica molecola” commenta Fabio Ciceri, professore ordinario di Ematologia all’Università Vita-Salute San Raffaele e direttore dell’Unità di Ematologia e Trapianto di Midollo Osseo dell’IRCCS Ospedale San Raffaele.
Nel caso della terapia sviluppata nei laboratori del San Raffaele, che riconosce WT1, il recettore TCR in grado di riconoscere la proteina è stato scelto, tra 19 candidati, non solo per la sua specificità ma anche perché proveniente da un donatore con una istocompatibilità – chiamata HLA-A02:01 – che è tra le più diffuse nei paesi occidentali. Ciò significa però che la terapia sperimentale potrà essere somministrata solo in pazienti con HLA-A02:01. Per gli altri pazienti occorrerà isolare altri TCR, sempre in grado di riconoscere WT1 ma compatibili con il loro sistema immunitario. Un limite importante ma temporaneo: il gruppo guidato dalla prof.ssa Bonini ne ha già identificati alcuni, che sono attualmente in corso di validazione.
Sullo stesso numero di STM esce in contemporanea un lavoro a primo nome Miranda Lahman e guidato da Aude Chapuis e Phil Greenberg, dell’Università di Washington e del Fred Hutchinson Cancer Research Center, che mostra come questo target terapeutico potrebbe ridurre il rischio di recidiva.
“Il fatto che questo primo recettore verrà sperimentato in clinica ci rende orgogliosi ed entusiasti, ma ci ricorda che è solo il primo passo. L’obiettivo finale è infatti costituire un repertorio di TCR, in grado non solo di funzionare in pazienti con diverse classi di istocompatibilità ma anche di riconoscere diversi tipi di proteine, associate a tumori sia solidi sia ematologici”, conclude Chiara Bonini. Un obiettivo ambizioso, su cui i ricercatori del San Raffaele hanno già iniziato a lavorare e che proseguirà nei prossimi anni, anche grazie al sostegno di Fondazione AIRC per la Ricerca sul Cancro.

 Salva come PDF
Salva come PDF